Mecanismos generadores da dor neuropática
Os mecanismos responsáveis pelo desenvolvimento da dor neuropática podem ser diferenciados em mecanismos periféricos e mecanismos centrais.
Mecanismos periféricos
Uma das causas comuns de dor neuropática é a lesão nervosa com dano axonal (por exemplo, infecção, neurotoxinas, isquemia), o que pode levar ao processo de degeneração Walleriana, não apenas por lesão direta, mas por actividade e presença ectópica das substancias libertadas no processo. Essas substancias (por exemplo, calcitoninas e óxido nítrico) também conduzem a mudanças nas propriedades biológicas das fibras não afetadas quando entram em contato com o ambiente inflamatório.
A actividade ectopica, ou seja, a geração de actividade espontânea anormal nos aferentes primários, causa sensação de dor. Em geral, a geração ectópica de impulsos nas fibras nociceptivas provoca dor espontânea e em fibras mecanorreceptoras causa parestesias e didestesias. O início da actividade pode ocorrer no receptor periférico ou nos gânglios dorsais do nervo periférico. Outro fenómeno associado a isso é a excitação efaptica de fibras nociceptivas derivada de alterações anatómicas e funcionais devido à lesão do nervo (por exemplo, conexões colaterais).
A sensibilização é outro mecanismo periférico que gera dor neuropática. É definida como alteração na sensibilidade neuronal na área de lesão ou na área circundante, isto é, uma diminuição no limiar de activação e um consequente aumento na frequencia de descarga. É chamada de sensibilização periférica quando se refere a estructuras perceptivas e sensibilização central quando se refere a mudanças nas estructuras do sistema nervoso central. Esta redução do limiar de excitação das células do sistema nociceptor é responsabilidade de agentes sensibilizadores, como mediadores anti-inflamatórios (por exemplo, a bradicinina, a serotonina, a histamina, a citosina e as prostaglandinas) que interagem com receptores ou canais iónicos, bem como os factores neurotróficos (factor de crescimento do nervo) que são liberados no processo de lesão ou no processo de inflamação.
A resposta imune derivada da lesão, incluindo a liberação de macrófagos, linfócitos e células satélites nos ganglios da raiz dorsal e a activação da microglia e a proliferação de astrocitos espinhais, também são processos responsáveis neste mecanismo de dor.
O sistema nervoso simpático também contribui para a dor neuropática pela liberação de catecolaminas, como a noradrenalina, que se liga aos receptores adrenérgicos na membrana dos nociceptores e leva à sua excitação inadequada (por exemplo, síndrome de dor regional complexa).
Em resumo, vários mecanismos de excitação neuronal após lesão nervosa do sistema nervoso periférico contribuem para o prolongamento dos processos de sensibilização e o consequente surgimento da dor neuropática.
Mecanismos centrais
Os mecanismos centrais são o conjunto de alterações neuroquímicas e neuroplasticas que induzem a ativação anormal dos neurónios centrais.
A alteração do sistema aferente pode levar a mudanças atróficas e perda de eficácia na conectividade com neurónios da coluna vertebral. Após este processo, há uma reorganização entre as fibras aferentes e as lâminas, a reorganização anatómica da medula espinhal. Os estímulos inofensivos podem ser percebidos como dolorosos, por exemplo, as fibras de Aβ não envolvidas no mecanismo de dor acabam em todas as lâminas dos cornos dorsais, exceto para a lâmina II, excluindo aferentes nociceptivos. No caso de lesão do nervo periférico, pode alterar o seu termo na lâmina II, portanto, a atividade das fibras de Aβ por um estímulo somatossensorial pode ser mal intrepertado como prejudicial (alodinia).
No nível central, o processo de sensibilização semelhante à sensibilização periférica também pode ocorrer. O processo de sensibilização central refere-se à diminuição do limiar de activação de neurónios na medula espinhal e outras áreas do circuito de dor, como córtex cingulado anterior ou amígdala. Esse fenómeno é dependente do uso e pode induzir mudanças plásticas no sistema nervoso e, portanto, ser comparado com a potencialização a longo prazo.
A desinibição é outro fenómeno que contribui para a dor neuropática. São alterações dos sistemas de modulação da dor a nível pré-sináptico, como postsináptica. As mudanças atróficas já mencionadas na secção anterior são mais evidentes nos pequenos neurónios inibitórios da medula espinhal, levando à redução da eficácia da inibição pelos interneurónios proprioespinhais.
A modulação central da dor também é afetada, uma vez que há alterações plasmáticas ao longo do circuito neuronal como a redução na inibição por caminhos descendentes endógenos. Esta diminuição funcional nas vias descendentes inibitórias serotoninérgicas e noradrenérgicas contribui para a sensibilização central e, por este processo, o tratamento com medicamentos antidepressivos é eficaz.
Qualquer lesão do nervo, à semelhança de uma amputação de um membro, causa uma desinfecção completa do território afetado e pode dar origem a sensações fantasmas. Após a lesão ocorrem alterações funcionais na representação somatópica cortical semelhante àquelas que ocorrem na medula espinhal, a reorganização central. Neste processo, a área correspondente da região lesionada reduz em tamanho e as áreas circundantes ocupam o território deixado livre. Aqui, podem ocorrer fenómenos neurológicos inadaptados, como a incongruência do novo mapa sensorial ou conexões de aferentes mecanicamente sensíveis com neurónios corticais não corrigidos.
Com isto, concluímos que a dor neuropática é diferente da dor nociceptiva ou inflamatória. Os mecanismos que produzem a sensação de dor são exclusivos de lesões ou disfunção do sistema nervoso. A principal diferença é que a dor nociceptiva e inflamatória são entendidas como processos fisiológicos necessários para a sobrevivencia, proteção e aprendizagem do organismo, enquanto que a dor neuropática é o resultado de um processo de neuroplasticidade inadaptada sem funcionalidade e, portanto, é entendido apenas como um processo patológico
A dor neuropática pode ser de origem periférica ou central e contribui com diferentes mecanismos plásticos que podem ocorrer em qualquer local de um circuito neural (receptores, medula espinhal, córtex cerebral).
A sensação de dor é uma consequencia da neuroplasticidade inadaptada após lesão inicial. É uma experiência sensível de caráter crónico que pode ser catalogada de formas diferentes como tipo espontaneo, alodinia, disestesia e parestesia entre outros. A esperança para a resolução deste transtorno e o desenvolvimento de terapias futuras está focada na investigação dos mecanismos de sensibilização e nos mecanismos de neuroplasticidade activados durante o processo de recuperação.
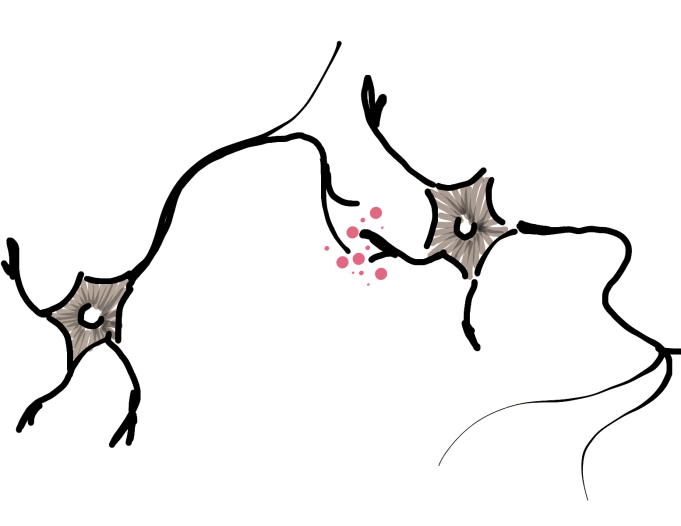 Mecanismos generadores del dolor neuropático
Mecanismos generadores del dolor neuropático
Los mecanismos responsables por el desarrollo de dolor neuropático pueden ser diferenciados en mecanismos periféricos y en mecanismos centrales.
Mecanismos periféricos
Una de las causas comunes de dolor neuropático es la lesión nerviosa con daño axonal (ej.:infección, neurotoxinas, isquemia), el cual puede llevar al proceso de degeneracion Walleriana no solo por la lesión directa si no por la actividad ectópica y la presencia de sustancias álgidas liberadas en el proceso. Estas sustancias (ej.:calcitoninas y oxido nítrico), también conducen a cambios en las propiedades biológicas de las fibras no afectadas cuando estas entran en contacto con el entorno inflamatorio.
La actividad ectópica, o sea la generación de actividad espontánea anormal en los aferentes primario, causa la sensación de dolor. En general la generación ectópica de impulsos en fibras nociceptivas causa dolor espontáneo y en fibras mecanoreceptivas causa parestesias y didestesias. El inicio de la actividad puede ocurrir en el receptor periférico o en el ganglio dorsal del nervio periférico. Otro fenómeno asociado a este es la excitación efáptica de fibras nociceptivas que deriva de cambios anatómicos y funcionales a raíz de la lesión nerviosa (ej.:conexiones colaterales).
La sensibilización es otro mecanismo periférico generador del dolor neuropático. Esta es definida como alteración en la sensibilidad neuronal en el área de lesión o en el área circundante, o sea, disminución del umbral de activación y consecuente aumento en la frecuencia de descarga. Es denominada de sensibilización periferica cuando se refiere a las estructuras perceptivas y sensibilización central cuando se refiere a cambios en las estructuras del sistema nervioso central. Esta disminuición del umbral de excitación de las células del sistema nociceptor es responsabilidad de los agentes sensibilizadores como los mediadores anti-inflamatorios (ej.:bradicinina, serotonina, histamina, citosina y prostaglandinas) que interactúan con los receptores o canales iónicos, así como de los factores neurotróficos (factor de crecimiento nervioso) que son liberados en el proceso de lesión o en el proceso de inflamación.
La respuesta inmune derivada de la lesión, que incluye la liberación de macrófagos, linfocitos y células satélite en los ganglios de las raíces dorsales y la activación de microglia y proliferación de astrositos a nivel medular, también son procesos responsables en este mecanismo del dolor.
El sistema nervioso simpático también contribuye al dolor neuropático por la liberación de catecolaminas como la noradrenalina que se une a los receptores adrenérgicos de la membrana de los nociceptores y conduce a su inadecuada excitación (ej.: síndrome del dolor regional complejo).
En resumen, son varios los mecanismos de excitación neuronal tras lesión nerviosa del sistema nervioso periférico que contribuyen para la prolongación de los procesos de sensibilización y consecuente surgimiento del dolor tipo neuropático.
Mecanismos centrales
Los mecanismos centrales son el conjunto de alteraciones neuroquímicas y neuroplásticas que inducen la activación anormal de las neuronas centrales.
La alteración del sistema aferente puede llevar a cambios atróficos y pérdida de eficacia en la conectividad con las neuronas espinales. Después de este proceso, hay una reorganización entre las fibras aferentes y láminas, la reorganización anatómica de la médula espinal. Estímulos inocuos pueden ser percibidos como dolorosos, por ejemplo, las fibras Aβ no involucradas en el mecanismo de dolor terminan en todas las láminas del asta dorsal excepto en la lamina II, exclusiva de aferencias nociceptivas. En caso de lesión nerviosa periférica puede alterar su termino en la lamina II, así la activicion de las fibras Aβ por un estimulo somatosensorial puede ser mal intrepertada como nociva (alodinia).
A nivel central también puede ocurrir el proceso de sensibilización semejante a la sensibilización periférica. El proceso de sensibilización central se refiere a la disminución del umbral de activación de neuronas de la medula espinal y otras áreas del circuito del dolor como corteza cingulada anterior o amígdala. Este fenómeno es uso-dependiente y puede inducir cambios plásticos en el sistema nervioso y así ser comparado con la potencialización a largo plazo.
La desinhibición es otro fenómeno que contribuye al dolor neuropático. Son alteraciones de los sistemas de modulación del dolor sea a nivel presináptico como postsináptico. Los cambios atróficos ya referidos en el apartado anterior son mas evidentes en las neuronas pequeñas inhibitorias de la médula espinal conduciendo a la reducción en la eficacia de inhibición por parte de las interneuronas propioespinales.
La modulación central del dolor también se ve afectada, una vez que hay alteraciones plásticas en todo el circuito neuronal como la reducción en la inhibición por vías descendentes endógenas. Esta disminución funcional de las vías descendentes inhibitorias serotonergicas y noradrenergicas contribuye a la sensibilización central y por este proceso el tratamiento con medicinas antidepresivas es efectiva.
Cualquier lesión nerviosa, a la semejanza de una amputación de una extremidad, causa una desaferentización completa del territorio afectado pudiendo originar sensaciones fantasma. Tras la lesión ocurren cambios funcionales en la representación somatópica cortical similares a los que ocurren en la medula espinal, la reorganización central. En este proceso la área correspondiente de la región lesionada reduce de tamaño y las áreas circundantes ocupan el territorio dejado libre. Aquí pueden ocurrir fenómenos neuroplásticos mal adaptativos como la incongruencia del nuevo mapa sensorial o conexiones de aferencias mecanicosensibles con neuronas corticales nocisensibles.
Con esto concluimos que el dolor tipo neuropático es distinto del dolor tipo nociceptivo o inflamatorio. Los mecanismos que producen la sensación del dolor son exclusivos de lesión o disfunción del sistema nervioso.
La principal diferencia es que el dolor nociceptivo e inflamatorio son entendidos como procesos fisiológicos necesarios para la supervivencia, protección y aprendizaje del organismo, mientras que el dolor neuropático es resultado de un proceso de neuroplasticidad maladaptativo sin funcionalidad y por lo tanto es entendido únicamente como proceso patológico.
El dolor neuropático puede ser de origen periférico o central y para ello contribuyen diferentes mecanismos plásticos que pueden ocurrir en cualquier localización de un circuito neuronal (receptores, medula espinal, corteza cerebral).
La sensación de dolor es consecuencia de la neuroplasticidad maladaptativa pós lesión inicial. Es una experiencia sensitiva de carácter crónico que puede ser catalogada de diferentes formas como tipo espontánea, alodinia, disestesia y parestesia entre otras.
La esperanza para la resolución de este trastorno y el desarrollo de futuras terapias esta centrado en la investigación de los mecanismos de sensibilización y en los mecanismos de neuroplasticidad activados durante el proceso de recuperación.